ガイドラインQ&A
H. pylori感染の診断と治療のガイドライン2016改訂版Q&A
1.適応疾患
- 「H. pyloriとの関連が推測されている疾患」についても除菌をすべきか
- 1「H. pyloriとの関連が推測されている疾患」に対しては、充分なエビデンスはありませんが、今後の臨床試験の結果によっては関連があると判断される可能性はあります。H. pyloriが感染している以上、「H. pyloriとの関連が推測されている疾患」をターゲットとして除菌するのではなく、「H. pylori感染胃炎」として除菌をすべきです。
- H. pylori陰性の胃MALTリンパ腫やITPもまず除菌を試みるべきか
- 2
胃MALTリンパ腫症例ではH. pylori除菌治療により約78%で完全寛解が得られることが示されており1)、H. pylori陽性の場合は除菌を試みるべきです。H. pylori陰性は、MALTリンパ腫の独立した治療抵抗因子であると報告されています2),3)。すなわち、H. pylori陰性の多くの場合は除菌治療が有効ではないと考えられます。しかし、H. pylori陰性MALTでも除菌が有効な例があり、特にH.suisなどH. pylori以外のHelicobacter属感染によるMALTには有効とする報告もあります4)。
ITPに関してはメタ解析でH. pylori除菌治療による血小板増加が有意であることが示されており5)、除菌が強く勧められます。H. pylori 陽性例でも除菌不成功の場合は血小板増加およびその後の維持ができないと報告されています6)。いっぽうH. pylori陰性患者では、除菌薬を投与しても血小板数の増加が見られないことが報告されています6)。
以上より、ITPにおいて、まず除菌を試みるというのは推奨されません。
1) Zullo A, Hassan C, Cristofari F, et al. Effects of H. pylori eradication on early stage gastric mucosa‒ associated lymphoid tissue lymphoma. Clin Gastroenterol Hepatol 2010;8:105‒110. 【メタ解析】
2) Nakamura S, Sugiyama T, Matsumoto T, et al. Long‒term clinical outcome of gastric MALT lym- phoma after eradication of Helicobacter pylori:a multicentre cohort follow‒up study of 420 patients in Japan. Gut 2012;61:507‒513.【コホート】
3) Inagaki H, Nakamura T, Li C, et al. Gastric MALT lymphomas are divided into three groups based on responsiveness to Helicobacter pylori eradication and detection of API2‒MALT1 fusion. Am J Surg Pathol 2004;28:1560‒1567.【コホート】
4) Nakagawa S, Shimoyama T, Nakamura M et al. The Resolution of Helicobacter suis-associated Gastric Lesions after Eradication Therapy. Intern Med 2017 Epub. 【ケースシリーズ】
5) Franchini M, Cruciani M, Mengoli C, et al. Effect of Helicobacter pylori eradication on platelet count in idiopathic thrombocytopenic purpura:a systematic review and meta‒analysis. J Antimicrob Chemother 2007;60:237‒246.【メタ解析】
6) Tsutsumi Y, Kanamori H, Yamato H, et al. Randomized study of Helicobacter pylori eradication therapy and proton pump inhibitor monotherapy for idiopathic thrombocytopenic purpura. Ann Hematol 2005;84:807‒811.【ランダム化】 - 除菌後GERD発生のリスクが高いような症例は除菌すべきではないのか
- 3
H. pylori 除菌後には GERD の発症や症状増悪の可能性が懸念されてきましたが、海外とわが国で微妙にアウトカムが異なります。海外ではいくつかのメタ解析がおこなわれていますが、一定のコンセンサスは得られていません。わが国では、除菌後に胃酸分泌が増加し「一過性に」酸逆流症状の出現や悪化、あるいは逆流性食道炎の増加が見られることが報告されています1)-3)。一方で消化性潰瘍患者に対して除菌しても、逆流性食道炎の発症は増加しないという報告4)や、十二指腸潰瘍を合併している逆流性食道炎の場合には、むしろ逆流性食道炎が改善するという報告5)や、十二指腸潰瘍合併例でなくても、1 年後には GERD 関連の QOLと酸逆流症状は改善するとの報告6)があり、背景にある病態によっては、除菌がGERDを抑制する場合もあります。除菌後のGERDを長期観察した場合もLos Angeles 分類の A,B の軽症者が大多数で、重症化することはほとんどない6), 7)と考えられます。以上から、除菌後GERDの発生増加は除菌治療の妨げにはならないと考えられます。
ただし、胃体部胃炎患者あるいは食道裂孔ヘルニア合併例では逆流性食道炎の発症リスクが高いという報告もあり4), 7)、当該患者にはあらかじめ説明しておく必要があります。
1) Hamada H, Haruma K, Mihara M, et al. High incidence of reflux oesophagitis after eradication therapy for H. pylori:impacts of hiatal hernia and corpus gastritis. Aliment Pharmacol Ther 2000;14:729‒735.【コホート】
2) Kawanishi M. Development of reflux esophagitis following Helicobacter pylori eradication. J Gastroenterol 2005;40:1024‒1028.【コホート】
3)Koike T, Ohara S, Sekine H, et al. Increased gastric acid secretion after Helicobacter pylori eradication may be a factor for developing reflux oesophagitis. Aliment Pharmacol Ther 2001;15:813‒820.【コホート】
4) Tsukada K, Miyazaki T, Katoh H, et al. The incidence of reflux oesophagitis after eradication therapy for H. pylori. Eur J Gastroenterol Hepatol 2005;17:1025‒1028.【コホート】
5) Ishiki K, Mizuno M, Take S, et al. Helicobacter pylori eradication improves pre‒existing reflux esophagitis in patients with duodenal ulcer disease. Clin Gastroenterol Hepatol 2004;2:474‒479. 【コホート】
6) Hirata K, Suzuki H, Matsuzaki J, et al. Improvement of reflux symptom related quality of life after Helicobacter pylori eradication therapy. J Clin Biochem Nutr 2013;52:172‒178.【コホート】
7) Sasaki A, Haruma K, Manabe N, et al. Long‒term observation of reflux oesophagitis developing after Helicobacter pylori eradication therapy. Aliment Pharmacol Ther 2003;17:1529‒1534.【コホート】 - 胃過形成性ポリープに対して除菌治療と内視鏡治療のどちらを優先すべきですか?
- 4
H. pylori除菌により7割程度の症例で胃過形成性ポリープが消失もしくは縮小することが報告されています1), 2)。よって多発例などでは治療の第一選択として除菌を行うよう勧められます。除菌後の経過観察で縮小傾向が見られないなど、切除が必要と思われる場合に内視鏡切除を考慮します。ただし、癌を否定出来ない場合3)や出血を伴うような症例では、先に内視鏡的切除術を行うことを考慮すべきです。その場合も、いずれかの時期に除菌治療を行う必要があります。
1) Ohkusa T, Takashimizu I, Fujiki K, et al. Disappearance of hyperplastic polyps in the stomach after eradication of H. pylori. A randomized, clinical trial. Ann Intern Med 1998;129:712‒715.【ランダム化試験】
2) Ji F, Wang ZW, Ning JW, et al. Effect of drug treatment on hyperplastic gastric polyps infected with Helicobacter pylori:a randomized, controlled trial. World J Gastroenterol 2006;12:1770‒ 1773.【ランダム化試験】
3) Horiuchi H, Kaise M, Inomata H, et al. Magnifying endoscopy combined with narrow band imaging may help to predict neoplasia coexisting with gastric hyperplastic polyps. Scand J Gastroenterol 2013;48:626‒632.【横断研究】 - H. pylori陽性の機能性ディスペプシア患者には最初に除菌治療を行うべきですか?
- 5
H. pylori 除菌治療は、機能性ディスペプシア(functional dyspepsia:FD) におけるFD患者の症状を有意に改善させることが示されています1)。とくに、除菌後 12 ヵ月以上経過をみた、14 のランダム化試験に絞ったメタ解析では、症状改善率が除菌群で40.6%と非除菌群の 34.0% に比べ有意に高く、なかでもH. pylori感染率の高いアジアで除菌効果が高いことが示されています2)。すなわち、高度の腎機能障害や、薬物アレルギーなど除菌治療の妨げになるような器質的疾患などが存在しない限り、H. pylori陽性のFD患者には最初に除菌治療を試みることを推奨します。
また、H. pylori 除菌施行後6~12 ヵ月後にディスペプシア症状の改善・消失が得られている場合は、H. pylori関連ディスペプシア“H. pylori‒associated dyspepsia”と定義する事が2016 年 5 月に発表された RomeIV基準にも踏襲されています3), 4)。
1) Moayyedi P. Helicobacter pylori eradication for functional dyspepsia:what are we treating?:com- ment on“Helicobacter pylori eradication in functional dyspepsia”. Arch Intern Med 2011;171: 1936‒1937.【メタ解析】
2) Zhao B, Zhao J, Cheng WF, et al. Efficacy of Helicobacter pylori eradication therapy on functional dyspepsia:a meta‒analysis of randomized controlled studies with 12‒month follow‒up. J Clin Gas- troenterol 2014;48:241‒247.【メタ解析】
3) Suzuki H, Mori H. Helicobacter pylori:Helicobacter pylori gastritis‒a novel distinct disease entity. Nat Rev Gastroenterol Hepatol 2015;12:556‒567.【総説】
4) Stanghellini V, Chan FK‒L, Hasler WL, et al. Gastroduodenal disorders. Gastroenterology 2016; 150:1380‒1392.【ガイドライン】 - 骨粗鬆症とH. pyloriの関係はありませんか
- 6H. pyloriと骨粗鬆症との関連性についての報告は増えつつありますが、「H. pylori除菌が強く勧められる疾患」に比べて明らかなエビデンスが充分に集積されていません。今後のエビデンスの集積に期待したいところです。
- 鳥肌胃炎症例の除菌後followはどうすればよいですか
- 7
鳥肌胃炎はH. pylori感染による過剰な免疫応答であり、特に若年者に好発する胃炎の一形態です。内視鏡では前庭部から胃角部の小結節隆起として捉えられ、色素撒布にて明瞭となります。隆起の中心には白色陥凹を認め、羽をむしり取った鳥の肌のように見えます。病理学的にはリンパ濾胞の著明な増生が認められます1)。鳥肌胃炎は若年者胃癌や未分化型胃癌や印環細胞癌の発生母地と報告されており2)-4)、除菌が推奨されます。除菌成功により小隆起は経時的に平坦化・消失することが多いです5)が、除菌後の胃癌発生の頻度やリスクファクターについては報告されていません。現時点では正確なfollowの間隔などは明らかではなく、除菌時の年齢、萎縮の程度、胃癌家族歴などを総合的に考慮して症例毎に検討することが望ましい対応と思われます。
1) De Giacomo C, Fiaccca R, Villani L, Lisato L, Diegoli N, Do- naadini A, et al. Helicobacter pylori infection and chronic gas- tritis: clinical, serological, and histologic correlations in children treated with amoxicillin and colloidal bismuth subcitrate. J Pediatr Gastroenterol Nutr. 1990;111:310–6.
2) Miyamoto M, Haruma K, Yoshihara M, Sumioka M, Nishisaka T, Tanaka S, et al. Five cases of nodular gastritis and gastric cancer: a possible association between nodular gastritis and gastric cancer. Dig Liver Dis. 2002;34:819–20.
3) Kamada T, Tanaka A, Yamanaka Y, et al. Nodular gastritis with Helicobacter pylori infection is strongly associated with diffuse-type gastric cancer in young patients. Dig Endosc 2007; 19: 180-184.
4) Imai K, Mitsunaga A, Araida T, Onizawa S, Shin Y, Nakano M. Advanced gastric cancer associated with nodular gastritis in a young patient. Clin J Gastroenterol. 2009;2(4):275-278.
5) Chen MJ, Shih SC, Wang TE, et al.Endoscopic patterns and histopathological features after eradication therapy in Helicobacter pylori –associated nodular gastritis. Dig Dis Sci (2008) 53: 1893.
2.診断
- ウレアーゼ活性に影響を与える具体的な薬剤は何ですか
- 1
まずは抗生物質などの抗菌薬が影響を及ぼすことは明確です。各種PPIはH. pyloriに対して抗菌活性を有しており、ウレアーゼ活性に影響を及ぼします。また、一部の防御因子増強薬(エカベトナトリウムなど)は抗ウレアーゼ活性を示します。新しい酸分泌抑制薬P-CAB(ボノプラザン)には抗菌薬活性はないとされていますが、ウレアーゼ活性を阻害し尿素呼気試験に影響するとされています1)。除菌判定には従来のPPIと同様に注意が必要です。
1) Takimoto M, Tomita T, Yamasaki T, et al. Effect of vonoprazan, a potassium-competitive acid blocker, on the 13C-urea breath test in Helicobacter pylori-positive patients. Dig Dis Sci. 2017; 62: 739-745.
- 血清抗体(Eプレート)の陰性高値について教えてください
- 2
現在国内で最もよく使用されるEIA法による測定キット「Eプレート栄研H.ピロリ抗体II」(Eプレート)の場合、感染診断のカットオフは10 U/mL以上とされています。しかし、陰性と判断されても抗体価が3 U/mL以上10 U/mL未満のカットオフに近い場合は「陰性高値」とされ、この場合20%弱の感染者が存在することが知られています。そのため、ガイドライン2016年版では、陰性高値者では他の検査で感染の有無を確認すべきであるとされています。このほど日本ヘリコバクター学会から新たに公表された「ピロリ菌血清抗体を加味した効果的な胃がん検診法と除菌を組み合わせた包括的胃がん予防のための推奨指針」1)においても、陰性高値者にはピロリ菌感染例と除菌後例が混在するので、適切なH. pylori感染診断を追加し、陽性の場合は除菌することが推奨されています。
1)日本ヘリコバクター学会.「ピロリ菌血清抗体を加味した効果的な胃がん検診法と除菌を組み合わせた包括的胃がん予防のための推奨指針」
- Eプレート以外の抗体測定系について教えてください
- 3
栄研のEプレートについで使用される機会が多いのは、同社が同じ抗原から作成したLZテストです1)。LZテストは測定が簡便であるラテックス法を用いて抗体価を測定します。そのほかにもデンカ生研、富士フィルム和光純薬からも血清抗体測定キットが発売されています2, 3)。これまでの報告では、どの方法も実臨床における感染診断の精度は十分と考えられます。しかし、血清抗体測定法はキットによって使用される抗原が違うので、診断精度は測定対象の感染率、胃粘膜萎縮の程度に影響されます。したがってEプレート以外の測定キットを胃がんリスク評価・H. pylori検診に使用する場合には、内視鏡など画像所見も参考にし、慎重に判断することが必要です。
1) 乾正幸, 大和田進, 乾純和ほか. ラテックス免疫比濁法を用いた血清Helicobacter pylori抗体検出キットの判定保留域(陰性高値・陰性低値)の解析. 日本消化器病学会誌 2017:114:1968-1977. 【横断研究】
2) 権頭健太、高橋悠、山道信毅ほか. H. pylori診断におけるH.ピロリ-ラッテクス「生研」及びH.ピロリIgG「」の有用性の検討. 日本消化器がん検診学会雑誌 2017:55:547-553. 【横断研究】
3) 乾正幸, 大和田進, 乾純和ほか. ラテックス免疫比濁法を用いた血清Helicobacter pylori抗体検出キットの実地臨床における有用性の検討-EIA法およびCLEIA法キットとの比較解析-. 日本ヘリコバクター学会誌2017:19:33-42. 【横断研究】 - 便中抗原はPPI服用に影響を受けませんか?
- 4
便中抗原測定法はキットによって使用されている抗体が認識する抗原が異なるため、PPIの影響もキットによって違います。国内で使用されているキットは2種類に大別できます。カタラーゼ抗原を認識する国産のキットはわかもと製薬が開発したもので、EIA 法のテストメイトピロリ抗原EIA(協和メディックス)と迅速型のイムノクロマト法のテストメイトラピッドピロリ抗原(日本ベクトン・ディッキンソン)があります。一方、Meridian Bioscience社が開発したものは複数の抗原に対するモノクローナル抗体が使用されているとされ、EIA法のHpSA ELISAⅡとイムノクロマト法のイムノカードST HpSA(いずれも富士レビオ)があります。国産のキットについてはPPIの影響が少なく1)、PPI内服中でも除菌判定が可能であったという報告もあります2)。しかし、海外産のキットではPPIの影響についての検討は不十分であり、欧州のキットがPPIの影響が受けると報告されていることから、今のところ保険診療ではPPI内服中の便中抗原測定はみとめられていません。
1) Kodama M, Murakami K, Okimoto T, et al.: Influence of proton pump inhibitor treatment on Helicobacter pylori stool antigen test. World J Gastroenterol 2012;18:44-48. 【横断研究】
2) Shimoyama T, Kato C, Kodama M, et al.: Applicability of a monoclonal antibody-based stool antigen test to evaluate the results of Helicobacter pylori eradication therapy. Jpn J Infect Dis 2009;62:225-227. 【横断研究】 - H. pylori診断時に複数検査が可能とはどういうことですか?どのようなときに複数検査を考えればよいですか?
- 5H. pyloriの存在診断の検査には100%信頼できるものはありません。したがって、保険診療においても、「ひとつの検査で陰性の場合は、もうひとつ他の検査を行うことをみとめる。」となっています。とくに、内視鏡でH. pylori菌感染胃炎が疑われるときには、ひとつの検査が陰性であっても、もうひとつ他の診断法を実施することをお勧めします。なお、「迅速ウレアーゼ試験と鏡検法」か「抗体測定、尿素呼気試験、便中抗原のうち2つ」の組み合わせに限り、保険診療で同時に2つの検査を行うことが可能です。
- 除菌判定検査は複数の検査を行うべきですか?
- 6ガイドライン2016年版では、「除菌判定には尿素呼気試験およびモノクローナル抗体を用いた便中H. pylori 抗原測定が有用であるが、複数の診断法を用いることにより厳密に除菌判定を行うことができる」とされています。これは感度・特異度が100%の検査が存在しないことと、除菌治療後では菌数が減少して偽陰性となる可能性があるためです。ITP、MALTリンパ腫のように除菌治療が無効な場合に他の治療を要する疾患では、除菌の成否は治療上重要なので、一つの検査が陰性の場合に他の検査で確認することが望ましいでしょう。また、除菌前後の内視鏡画像が参照できる場合には画像診断との整合性を確認して、除菌判定の結果が疑わしければ他の検査で除菌の成否を確認すべきでしょう。最初の検査が陽性であった場合は2つ目の検査は保険診療では認められないことに留意する必要があります。
- 除菌判定時UBTがカットオフに近い場合の対応を教えてください?
- 7
UBTのカットオフ値は2.5‰となっていますが、除菌判定時にはカットオフ値周辺の結果が出ることがあります1)。2.5-5.0‰の場合は偽陽性のことがありますので、2-3か月以上、間隔を空けて再検することが推奨されます。それでも同様の値の場合は他の検査を行うか、内視鏡検査を行うことが正しい除菌判定に必要なこともあります。
1) Kato C, Sugiyama T, Sato K,et al. Appropriate cut-off value of 13C-urea breath test after eradication of Helicobacter pylori infection in Japan. J Gastroenterol Hepatol 2003;18:1379-83. 【横断研究】
- 市販の抗H. pylori抗体を用いた免疫染色はH. pylori以外のHelicobacterも陽性になりますか?
- 8
市販の抗H. pylori抗体を用いた免疫染色ではH. pylori以外のHelicobacterも陽性となることが報告されています1-3)。H. pylori以外のHelicobacter属菌は、近年Non-H. pylori Helicobacters (NHPH)と呼ばれており、ヒト胃粘膜にもNHPHの感染がみられます4)。ヒト胃粘膜に感染がみられるNHPH は従来Helicobacter heilmannii-like organism (HHLO)と呼ばれてきたもので、H. suis, H. heilmannii, H. bizzozeronii,H. felis等が知られています4, 5)。HHLOの多くはH. suisです6)。HHLOが典型的な螺旋形態を示す場合はその形態がH. pyloriと異なっているためH. pyloriとの鑑別が可能です4)。螺旋形態を示したHHLOはH. pyloriよりも大型で螺旋が強く、胃粘膜上皮に接着することなく、胃粘膜上皮表面の粘液ゲル内や胃小窩内に観察されます。しかしながら、HHLOはしばしば壁細胞の細胞内分泌細管内に侵入することがあります。細胞内分泌細管内のHHLOや球状体構造を呈したHHLOは形態的にはH. pyloriとの鑑別が困難となります3)。H. felisを除き、ヒト胃粘膜からのHHLOの培養法は確立していないため、菌種の同定には胃生検組織を用いた、HHLOのウレアーゼ遺伝子解析が必要となります7)。
1) Singhal AV, Sepulveda AR. Helicobacter heilmannii gastritis: a case study with review of literature. Am J Surg Pathol 2005;29:1537-1539.【症例報告】
2) Matsumoto T, Kawakubo M, Akamatsu T, et al. Helicobacter heilmannii sensu stricto-related gastric ulcers: a case report. World J Gastroenterol 2014;20:3376-82.【症例報告】
3) Kobayashi M, Yamamoto K, Ogiwara N, et al. Helicobacter heilmannii-like organism in parietal cells: A diagnostic pitfall.Pathol Int. 2016;66:120-122. 【症例報告】
4) Haesebrouck F, Pasmans F, Flahou B, et al. Gastric helicobacters in domestic animals and nonhuman primates and their significance for human health. Clin Microbiol Rev 2009,22:202-223【総説】
5) Flahou B, Rossi M, Bakker J, et al. Evidence for a primate origin of zoonotic Helicobacter suis colonizing domesticated pigs. ISM J 2018,12:77-86.【横断研究】
6) Van den Bulck K, Decostere A, Baele M, et al.Identification of non-Helicobacter pylori spiral organisms in gastric samples from humans, dogs, and cats. J Clin Microbiol 2005,43:2256-2260. 【横断研究】
7) O'Rourke JL, Solnick JV, Neilan BA, et al.:Description of 'Candidatus Helicobacter heilmannii' based on DNA sequence analysis of 16S rRNA and urease genes. Int J Syst Evol Microbiol. 2004;54:2203-2211.【横断研究】 - 尿中抗体のEIA法は血清抗体と同様の取り扱いでいいですか?
- 9
尿を用いる抗体測定検査では、凍結保存後に偽陰性が、タンパク尿がある場合には偽陽性となる場合があります。特にタンパク尿の頻度の高い若年者では注意が必要です。EIA法により尿中抗体測定を行った場合は結果が数値で表されますが、血清抗体のEIA法による測定とは異なり、半定量的試験です。保険診療上も半定量的試験とされており、保険点数も血清抗体と異なっています。したがって尿中抗体測定は感染診断には有用ですが、EIA法による測定であっても、血清抗体のように治療前後の数値の比較による除菌判定には使用できません。
1) Mabe K, Kikuchi S, Okuda M, et al. Diagnostic accuracy of urine Helicobacter pylori antibody test in junior and senior high school students in Japan. Helicobacter 2017:22. doi: 10.1111/hel.12329.【横断研究】
2) Shimoyama T, Sawada Y, Sawada N, et al. Accuracy of stick-type kit and enzyme-linked immunosorbent assay for the detection of urinary Helicobacter pylori antibodies in a population of Japan Sea region of northern Japan. Jpn J Infect Dis 2017:70:207-209.【横断研究】
3.治療
- ワルファリン服用例の除菌法について
- 1
ワルファリン内服時にH. pyloriの除菌薬を内服するとワルファリンの抗凝固作用が増強される可能性があります。そのため、適応を十分に検討した上で、安全に注意して行う必要があります。
プロトンポンプ阻害薬(PPI)やクラリスロマイシン(CAM)、メトロニダゾール(MNZ)はワルファリンの代謝酵素を介する薬物間相互作用によって、ワルファリンの代謝をおくらせ、結果としてワルファリンの効果が強まります1)。なお、Vonoprazanとワルファリンの相互作用に関してはデータが不十分です。また、アモキシリン(AMPC)、CAM、MNZは腸内細菌に影響し、それらはビタミンKの産生低下につながり、結果としてワルファリンの効果が増強されます。従って、H. pyloriの除菌薬はワルファリンの抗凝固作用を増強させることとなり、注意が必要です1)。添付文書上では、除菌薬の何れも併用禁忌ではなく併用注意薬であるため2)、慎重投与は可能ですが、基本的には除菌療法の適応とリスクベネフィットバランスを考慮して除菌を行うかを決定すべきと考えます。除菌を行う場合には、十分に患者に説明したうえでICを取得後、INR等でモニターしつつ、慎重に行わざるをえないと考えます。
ワルファリンの内服が中止できるならば、中止して除菌を行うべきと考えます。特に、将来的にカテーテル治療等でワルファリンの服用が中止なるようでしたらその後でよいと考えます。
1) Furuta T, Graham DY. Pharmacologic aspects of eradication therapy for Helicobacter pylori Infection. Gastroenterology clinics of North America 2010;39:465-80.
2) エーザイ株式会社. ワーファリン錠0.5 mg, 1mg 5 mg ワルファリン. ワーファリン添付文書 2016. - クラリスロマイシン(CAM)と薬物間相互作用がある薬物服用例の除菌法
- 2
CAMはCYP3A4の阻害薬であり、同じ酵素やトランスポーターで代謝・輸送される薬物の動態に影響します1)。同酵素で代謝される薬物との相互作用に十分注意が必要です2)。エルゴタミンはCAMと併用禁忌です。エルゴタミンとの併用ではその血管収縮作用を増強させます2)。併用禁忌薬には、この他に、ピモジド、チカグレロル等、7剤あります。併用注意薬には、カルバマゼピン、テオフィリン、アトルバスタチンカルシウム水和物、シンバスタチン、ベンゾジアゼピン系薬、カルシウム拮抗薬(ニフェジピン、ベラパミル等)、ワルファリンカリウム等があります。スタチンは、併用で血中濃度が上昇し、横紋筋融解症が生じることがあります。ワルファリンではINRの上昇、カルシウム拮抗薬では徐脈や低血圧のリスクがあります2)。ジゴキシンは、腸内細菌に影響し、不活化が抑制されたり、輸送阻害が生じ、血中濃度が上昇します3)。スルホニル尿素系血糖降下薬は、機序は明確ではないですが、CAMとの併用により血中濃度が上昇する可能性があります3)。これらを含め、併用注意薬は30剤以上あります。除菌対象患者さんが他の医薬品を服用中の場合では、添付文書で確認したり、薬剤師に相談することが必要です。
これらの薬物を服用中の症例の除菌では、CAMとの併用を避ける必要があります。可能なら、除菌薬服用期間中は、それらの薬物の服用を中止します。もし中止が不可能ならば、CAMの使用を避けなければなりません。従って、CAMではなくMNZを用いた2次除菌レジメで除菌を行う必要がありますが、MNZも併用禁忌や注意が多い薬物ですので相互作用には十分に注意する必要があります。
文献
1) H. pylori感染の診断と治療のガイドライン2016改訂版.日本ヘリコバクター学会ガイドライン作成委員会編、先端医学社,東京,2016.
2) 古田 隆久, 杉本 光繁, 山出 美穂子, 他: Helicobacter pylori感染症診療のPitfall(第3回) 合併症を有する患者、併用薬のある患者に対するHelicobacter pylori除菌療法. Helicobacter Research 2013;17:284-90.
3) クラリス錠200 添付文書.2019年4月改訂.大正製薬株式会社. - メトロニダゾール(MNZ)の脳脊髄疾患症例での使用について (禁忌の確認)
- 3
MNZの添付文書に、【禁忌(次の患者には投与しないこと)】2.脳,脊髄に器質的疾患のある患者(脳膿瘍の患者を除く)[中枢神経系症状があらわれることがある。]と記載されています1)。
独立行政法人医薬品医療機器総合機構の、審査報告書 平成 24 年 7 月 3 日2)に、脳・脊髄に器質的疾患のある患者おける禁忌についての記載があります。
「国内使用実態調査及び海外文献では、脳、脊髄に器質的疾患のある患者 に対する安全性上の問題は認められなかったものの、国内外の副作用報告では、脳・脊髄に器質的疾患のある患者において重篤な中枢神経系の副作用が認められており、 死亡例や後遺症の残る症例も認められていることから、今後も脳・脊髄に器質的疾患のある患者を禁忌と設定することが適切と考える。ただし、「脳膿瘍」については、死亡や神経学的後遺症を生じる恐れのある重篤な疾患であり、脳膿瘍に対する本剤の治療の必要性は高いと考えられることから、脳膿瘍の患者については本剤投与が可能となるよう慎重投与とし、重要な基本的注意において中枢神経障害の発現について注意喚起することが適切と考える。」
従って、脳・脊髄に器質的疾患のある症例では、MNZを用いた除菌は、出来ません。
文献
1) フラジール4250㎎錠 添付文書 2017年1月改訂.塩野義製薬株式会社.
2) 審査報告書 平成 24 年 7 月 3 日 独立行政法人医薬品医療機器総合機構. - CAM耐性菌でもVonoprazanを用いた一次除菌で成功率が高いのはなぜですか?
- 4
Vonoprazanの強力な胃酸分泌抑制作用により、AMPCの効果がより高まるためと推察されます。Vonoprazanによる胃酸分泌抑制効果はPPIよりも強力です1)。H. pylori の抗生物質への感受性はpHに依存し、中性域に近いほど感受性が高まります2)。AMPCの標的であるペニシリン結合タンパクの発現は、強酸性域ではほとんど発現がありませんが、pHが中性に近くなると発現が高まり、AMPCの標的が増えることとなり、よく効くこととなります3)。また、中性域では抗生物質の胃内での安定化や胃粘液中の濃度も高まります4)。以上の結果、CAMが効かない状況でも、Vonoprazanによる強力な胃酸分泌抑制作用はAMPCの効果がより発揮できる環境が整うため、比較的高い除菌率がえられると考えられます。CAM耐性菌に対して、中性のpH環境でCAMが効果を示すようになるかは不明です。
1) Kagami T, Sahara S, Ichikawa H, et al. Potent acid inhibition by vonoprazan in comparison with esomeprazole, with reference to CYP2C19 genotype. Aliment Pharmacol Ther 2016;43:1048-59.
2) Graham DY, Fischbach L. Helicobacter pylori treatment in the era of increasing antibiotic resistance. Gut 2010;59:1143-53.
3) Marcus EA, Inatomi N, Nagami GT, Sachs G, Scott DR. The effects of varying acidity on Helicobacter pylori growth and the bactericidal efficacy of ampicillin. Aliment Pharmacol Ther 2012;36:972-9.
4) Goddard AF, Jessa MJ, Barrett DA, et al. Effect of omeprazole on the distribution of metronidazole, amoxicillin, and clarithromycin in human gastric juice. Gastroenterology 1996;111:358-67. - 最も除菌成功が期待できる治療法とはどういうことですか?
- 5
文字通り、除菌率が高い治療レジメということになります。除菌レジメンは、高い除菌率が期待できるものから選択されるべきであり、世界的にも90%以上の除菌率が達成できるレジメンを用いることが推奨されています1)。本邦における一次除菌治療で最も除菌の成否に影響している因子は、CAM感受性です。CAM感受性菌であれば、三剤PPI/AMPC/CAM療法の除菌率は90%以上が期待できますが、耐性菌では40%程度に低下します1)。CAM感受性菌に対してはCAMを用い、耐性菌にMNZを用いた場合では94.3%の除菌率がえられます2)。従って、本ガイドラインでは、除菌療法における薬物の選択は、薬剤感受性試験を行い、最も高い除菌率が期待される組み合わせにすることを推奨しています。
文献
1) H. pylori感染の診断と治療のガイドライン2016改訂版.日本ヘリコバクター学会ガイドライン作成委員会編、先端医学社,東京,2016.
2) Kawai T, Yamagishi T, Yagi K, et al. Tailored eradication therapy based on fecal Helicobacter pylori clarithromycin sensitivities. J Gastroenterol Hepatol 2008; 23 Suppl 2:S171-174. - 治療期間を7日間ではなく10日間あるいは14日間にすると除菌率が高まりますか
- 6
Cochrane LibraryのYuanら1)のIntervention Reviewで検討結果が示されています。抗生剤の用量や種類によらず、PPI triple therapyの7日から14日間への延長は、除菌率を有意に向上させます(45 研究、72.9% 対81.9%)、H. pylori 陽性持続の相対危険度(RR)は、0.66 (95%信頼区間(CI) ( 0.60~0.74)でした。サブグループ解析では、PPI + CAM+ AMPC(PCA )でRR 0.65, 95%CI 0.57 ~0.75 (34 研究)、PPI + AMPC+ ニトロイミダゾール(PAN)で RR 0.67, 95% CI 0.52 ~0.86 (10 研究)でした。有意の除菌率向上は、 10 日対7日 (24研究、 79.9% 対75.7%;RR 0.80, 95% CI 0.72 ~0.89)、 14 日対10 日(12 研究、84.4% 対78.5%; RR 0.72, 95%CI 0.58 ~0.90)でも見られました。サブグループ解析では、PACの 10 日対7 日でRR 0.80, 95% CI 0.70 ~0.91 (17研究)、14 日対10 日で RR 0.69, 95% CI 0.52 ~0.91 (10研究)でした。
副作用頻度は、7日と14日の間でのみわずかに有意に増加しました (15.5% versus 19.4%; RR 1.21, 95% CI 1.06 ~1.37) が、ほかの日数間の比較では有意差はありませんでした。 PCAでは、14 日の症例は7 日の症例より有意に多くの副作用がありました (19.6% 対16.0%; RR 1.21, 95% CI 1.06 ~1.39)。副作用により治療中止に至った症例の比率は、治療日数間で有意差はありませんでした。
7日間よりも14日間で除菌率は上がりますが、副作用も増える結果でした。
一方、Vonoprazanを用いた除菌療法の成績では投与期間が7日間より長い投与の報告はなく、現状では7日が推奨されます。
文献
1) Yuan Y, Ford AC, Khan KJ, et al. Optimum duration of regimens for Helicobacter pylori eradication. Cochrane Database Syst Rev. 2013 Dec 11;(12):CD008337. doi:10.1002/14651858.CD008337.pub2 - 薬剤感受性試験を行いCAM耐性の場合は最初から二次除菌レジメで除菌して良いですか?
- 7
日本消化器病学会のホームページに掲載の、 「ヘリコバクター・ピロリ感染胃炎」に対する除菌治療に関するQ&A一覧 (http://www.jsge.or.jp/member/shikkan_qa/helicobacter_pylori_qa) において、以下の記載があります。
Q.1次除菌、2次除菌の順番は変更できるのでしょうか?また、CAM耐性菌であることが判明している場合にはどうするのでしょうか?
A.保険診療では1次除菌と2次除菌の順番の変更はできません。ただし、CAM耐性菌であることが判明している場合は、医療費削減の面からも診療録および診療報酬明細書の摘要欄にCAM耐性である証拠(感受性検査の実施施設および施行日と結果)を記載して2次除菌を使用すべきです。 - 一次除菌に失敗した時はCAM用量を400mgから800mgに上げて治療すべきですか?
- 8
一次除菌でCAM を含んだレジメンによる除菌不成功後には CAM 耐性獲得が報告されています1)2)。三剤PPI/AMPC/CAM療法による一次除菌不成功後では、CAM耐性率は83.3%と報告されています3)。CAM耐性菌では、PPI/AMPC/CAM療法の除菌率は40%程度に低下します4)。
無作為割付試験(RCT)でPPI/AC療法のCAM1日400 mgと800 mgのCAM耐性菌の除菌率を比較した報告は、多くはありません。Murakamiら5)は、PPI-triple therapyで、CAM耐性菌の除菌率は、ラべプラゾール(R) 10 mg + AMPC(A) 750 mg + CAM (C) 200 mg 1日2回7日で50% (1 ⁄ 2)、R 20 mg + A 750 mg + C 200 mg 1日2回7日で0% (0 ⁄ 6) 、R 20 mg + A 750 mg + C 400mg 1日2回7日で0% (0 ⁄ 4) であったと報告しています。Kuwayamaら6)は、R +A+C 1週間で、CAM耐性菌の除菌率は、C 1日400㎎群で46% (15/33) 、800 mg群で56% (15/ 27) で、有意差は見られていません。
したがって、1次除菌に失敗した時は、CAM耐性性菌に対する治療が必要であり、CAMの増量による治療は行うべきではありません。CAMをMNZに変えた2次除菌レジメを用いるべきです。
文献
1) Kobayashi I, Murakami K, Kato M, et al. Changing antimicrobial susceptibility epidemiology of Helicobacter pylori strains in Japan between 2002 and 2005. J clin microbiol 2007;45:4006-4010.
2) Murakami K, Fujioka T, Okimoto T, et al. Drug combinations with amoxycillin reduce selection of clarithromycin resistance during Helicobacter pylori eradication therapy. Int J Antimicrob agents 2002;19:67-70.
3) 橋永正彦, 沖本忠義, 兒玉雅明, 他: わが国における薬剤耐性 Helicobacter pyloriの現状 -2013-2014年度耐性菌サーベイランスの集計報告. 日本ヘリコバクター学会誌 2016;17:45-49.
4) pylori感染の診断と治療のガイドライン2016改訂版.日本ヘリコバクター学会ガイドライン作成委員会編、先端医学社,東京,2016.
5) Murakami K, Sato R, Okimoto T, et al. Eradication rates of clarithromycin-resistant Helicobacter pylori using either rabeprazole or lansoprazole plus amoxicillin and clarithromycin. Aliment Pharmacol Ther 2002;16:1933-8.
6) Kuwayama H, Asaka M, Sugiyama T, et al. Rabeprazole-based eradication therapy for Helicobacter pylori: a large-scale study in Japan. Aliment Pharmacol Ther 2007;25:1105-13. - 除菌治療に抗菌薬耐性整腸剤を併用することは有用ですか?
- 9
H. pylori除菌療法におけるプロバイオティクスの効果について、ガイドラインでは以下のように記載しています1)。 H. pyloriの除菌療法に際し、プロバイオティクスの併用は、除菌率の上乗せ効果と副作用の軽減効果が期待されます。Dang 等2)のメタ解析では、特定の菌種のプロバイオティクスには、除菌の上乗せ効果があるとしています。一方、Lu等3)67のメタ解析では、除菌率の上乗せ効果は有意ではなかったとしていますが、下痢や悪心といった副作用はプロバイオティクスの併用にて有意に低減できるとしています。
文献
1) H. pylori感染の診断と治療のガイドライン2016改訂版.日本ヘリコバクター学会ガイドライン作成委員会編、先端医学社,東京,2016.
2) Dang Y, Reinhardt JD, Zhou X, Zhang G. The effect of probiotics supplementation on Helicobacter pylori eradication rates and side effects during eradication therapy: a meta-analysis. PloS One 2014;9:e111030.
3) Lu C, Sang J, He H, et al. Probiotic supplementation does not improve eradication rate of Helicobacter pylori infection compared to placebo based on standard therapy: a meta-analysis. Sci Rep 2016;6:23522. - ペニシリンアレルギー患者に対する保険適用の除菌治療と自由診療の除菌治療を教えて下さい。
- 10
ペニシリンアレルギー患者に対する除菌療法で保険適用のものは原則的にはありません。但し、症状詳記を記載することによって、CAMとMNZと胃酸分泌抑制薬との組み合わせは、査定されないことがあります。自由診療のレジメンとしては、胃酸分泌抑制薬に加えて、シタフロキサシン(STFX)とMNZ、ミノサイクリンとMNZ等の報告があります1,2)。
1) Furuta T, Sugimoto M, Yamade M, et al. Eradication of H. pylori Infection in Patients Allergic to Penicillin Using Triple Therapy with a PPI, Metronidazole and Sitafloxacin. Intern Med 2014;53:571-5.
2) Murakami K, Sato R, Okimoto T, et al. Effectiveness of minocycline-based triple therapy for eradication of Helicobacter pylori infection. J Gastroenterol Hepatol 2006;21:262-7. - 高度腎機能障害や透析患者に対する除菌治療はどうすると良いですか?
- 11
高度腎機能障害の場合には薬物の用量を減じるなどの調整が必要となることがあります。AMPCを含むレジメンの投与により腎機能が増悪したとする報告があります1)。一方で、PPIとCAM、MNZの組み合わせは腎機能に影響なかったと報告されています1)。除菌薬の内服によって腎機能を悪化させる可能性がないわけではないため、除菌療法の適応について十分な検討が必要です。その上で、薬物の用量の調整が必要です。特に、AMPCの用量は1/2から1/3に減じる必要があると考えます2)。
透析例では、PPI は1回投与、AMPCも250mgの1日1カプセルを1回投与、CAMは200 mgを一回投与、透析日は透析後に投与します。透析例では薬物の血中濃度が高くなるため、副作用リスクが高まるからです。一方で、透析性のある薬物を透析前に投与すると、透析にてぬけてしまいますので、用量を減じた上で透析後に投与します。
1) Sheu BS, Huang JJ, Yang HB, Huang AH, Wu JJ. The selection of triple therapy for Helicobacter pylori eradication in chronic renal insufficiency. Aliment Pharmacol Ther 2003;17:1283-90.
2) 日本ヘリコバクター学会ガイドライン作成委員会. H. pylori感染の診断と治療のガイドライン 2016改訂版. 先端医学社 2016. - 3次除菌治療法の具体的な方法と注意点を教えてください。
- 12
日本の3次除菌RCTの論文が発表されています。いずれも、STFXを用いたレジメンです。
Furutaら1)は、ITT除菌率(95%信頼区間, CI)が、ラべプラゾール10㎎ b.i.d.ないしq.i.d. (CYP2C19遺伝子多型の高速代謝型と中間代謝型はq.i.d.、低速代謝型はb.i.d.)+AMPC 500 mg q.i.d.+STFX100 mg b.i.d.の1週間投与で84.1%(69.9~93.4%)、ラべプラゾール10㎎ b.i.d.ないしq.i.d.+MNZ 250 mg b.i.d.+STFX100 mg b.i.d.の1週間投与で90.9%(78.3~97.5%)と報告しています。副作用としては、軽度の下痢、軟便がみられましたが、重篤なものはありませんでした。
Moriら2)は、ITT除菌率(95%CI)が、エソメプラゾール20 mg b.i.d.+AMPC 500 mg q.i.d.+STFX 100 mg b.i.d.の10日間投与で81.0%(71.0~90.9%)、エソメプラゾール20 mg b.i.d.+MNZ250 mg b.i.d.+STFX 100 mg b.i.d.の10日間投与で72.4%(60.6~84.3%)と報告しています。副作用は、各群1例が倦怠感、下痢のため治療中断しましたが、中止後に回復しています。その他は、下痢、軟便等の軽度のものしか見られませんでした。
なお、STFX(商品名:グレースビット)の添付文書の2019年1 月改訂(第14版)3)で、大動脈瘤、大動脈解離が、慎重投与、重大な副作用に加わりました。大動脈瘤、大動脈解離を引き起こすことがあるので、観察を十分に行うこと、大動脈瘤又は大動脈解離を合併している患者、大動脈瘤又は大動脈解離の既往、家族歴若しくはリスク因子を有する患者では、必要に応じて画像検査の実施も考慮すること、等が記載されています。
文献
1) Furuta T, Sugimoto M, Kodaira C, et al. Sitafloxacin-based third-line rescue regimens for Helicobacter pylori infection in Japan. J Gastroenterol Hepatol 2014;29:487-93.
2) Mori H, Suzuki H, Matsuzaki J, et al. Efficacy of 10-day Sitafloxacin-Containing Third-Line Rescue Therapies for Helicobacter pylori Strains Containing the gyrA Mutation. Helicobacter 2016;21:286-94.
3) 第一三共株式会社.グレースビット錠50㎎、グレースビット細粒10% 添付文書.2019年1 月改訂(第14版). - H. pylori の除菌の際にH2受容体拮抗薬を併用しても大丈夫でしょうか。
- 13
H. pylori の除菌療法におけるPPIやVonoprazanは除菌の補助薬です。従って、併存する胃潰瘍や慢性胃炎や逆流性食道炎に対してH2受容体拮抗薬を併用することは一次除菌療法においても二次除菌療法においても保険診療上問題ないと解釈できます。一次除菌療法においてはH. pyloriの除菌にH2受容体拮抗薬を併用することで除菌率が有意に向上することが報告されています1)。二次除菌療法での除菌率に対する効果は示されていません。(なお、PPIやVonoprazanを除菌の補助として用いている状況で、さらに、消化性潰瘍や併存するGERDに対してさらにPPI等を併用することは、PPIの総用量が薬機法で定められた用量を超えしまうため不可能です。)
1) Okudaira K, Furuta T, Shirai N, Sugimoto M, Miura S. Concomitant dosing of famotidine with a triple therapy increases the cure rates of Helicobacter pylori infections in patients with the homozygous extensive metabolizer genotype of CYP2C19. Aliment Pharmacol Ther 2005;21:491-7
- プロトンポンプ阻害薬(PPI)の除菌にて一次除菌二次除菌失敗した場合に、Vonoprazanでの除菌を一次除菌から繰り返してもよいでしょうか?
- 14
厚労省からの通知1)によれば、「除菌後の感染診断の結果、ヘリコバクター・ピロリ陽性の患者に対し再度除菌を実施した場合は、1回に限り再除菌に係る費用及び再除菌後の感染診断に係る費用を算定することができる。」とあります。保険診療上は、VonoprazanもPPIと同種同効薬ですので、PPIの除菌にて一次除菌二次除菌失敗した場合は、酸分泌抑制薬を変更しても次は三次除菌療法となり、保険適応外となります。
1) 厚生労働省保険局医療課長発通知(平成25年2月21日付.保医発0221 第31号.平成25年2月21日適用)
- クラリスロマイシン(CAM)の400 mgと800 mgの使い分けについて教えて下さい。
- 15
除菌療法でのCAMの用量については、ガイドラインに記載がありますように、200 mg 1日2回が推奨されます1)。
CAM 200 mg 1日2回と 400 mg 1日2回の用量の違いによる除菌率の差は、各PPI、Vonoprazanの臨床試験の際に認められていません。副作用については、差を認めないとする報告や400 mg 1日2回の方が多いとの報告があります。RPZ/AMPC/CAM療法の大規模な市販後調査2)において、3789例での副作用の出現要因について因子分析を行った結果では、CAM 400 mg 1日2回の方が副作用頻度が有意に高い(OR 2.130; P<0.0001)ことが示されています。
この様に、CAM 200 mg 1日2回と400mg 1日2回では除菌率に差はありませんが、400mg 1日2回では副作用頻度が高まるため、200 mg 1日2回が推奨されます。
文献
1) H. pylori感染の診断と治療のガイドライン2016改訂版.日本ヘリコバクター学会ガイドライン作成委員会編、先端医学社,東京,2016.
2) Fujioka T, Aoyama N, Sakai K, et al. A large-scale nationwide multicenter prospective observational study of triple therapy using rabeprazole, amoxicillin, and clarithromycin for Helicobacter pylori eradication in Japan. J Gastroenterol 2012; 47:276-283. - 除菌療法に上乗せ効果のある薬物について
- 16
除菌に上乗せ効果がある薬物としては、エカベトナトリウムとプロバイオティクスがあります。
エカベトナトリウムはH. pyloriの除菌率を向上させるという報告があります1,2)。エカベトナトリウムにはH. pyloriの抗ウレアーゼ作用があります3,4)。詳細な除菌の上乗せ効果の機序は不明ですが、エカベトナトリウムの抗ウレアーゼ作用はpHが低いほど効果が強いとされています。PPIによるpH上昇が十分の場合には抗生物質の殺細胞効果がよく発揮されてH. pylori は死滅します、一方、胃酸分泌抑制が不十分の場合には抗菌薬の作用は低下しますが、エカベトナトリウムの抗ウレアーゼ作用によりH. pyloriのウレアーゼの作用が障害され、酸性環境に適応できず死滅すると考えられます。
プロバイオティクスの効果に関しては、除菌率を向上させるという報告5)と、副作用の軽減6)の二つの効果が報告されています。
1) Ohkusa T, Takashimizu I, Fujiki K, et al. Prospective evaluation of a new anti-ulcer agent, ecabet sodium, for the treatment of Helicobacter pylori infection. Aliment Pharmacol Ther 1998;12:457-61.
2) Shimoyama T, Fukuda Y, Fukuda S, Munakata A, Yoshida Y. Ecabet sodium eradicates Helicobacter pylori infection in gastric ulcer patients. J Gastroenterol 1996;31 Suppl 9:59-62.
3) Ito Y, Hongo A, Kinoshita M, Tamaki H. Mechanism of anti-urease action by the anti-ulcer drug ecabet sodium. Biological & pharmaceutical bulletin 1995;18:850-3.
4) Ito Y, Shibata K, Hongo A, Kinoshita M. Ecabet sodium, a locally acting antiulcer drug, inhibits urease activity of Helicobacter pylori. European journal of pharmacology 1998;345:193-8.
5) Dang Y, Reinhardt JD, Zhou X, Zhang G. The effect of probiotics supplementation on Helicobacter pylori eradication rates and side effects during eradication therapy: a meta-analysis. PloS one 2014;9:e111030.
6) Lu C, Sang J, He H, et al. Probiotic supplementation does not improve eradication rate of Helicobacter pylori infection compared to placebo based on standard therapy: a meta-analysis. Scientific reports 2016;6:23522. - 二次除菌療法に関して、メトロニダゾール(MNZ)服用終了後お酒は何時間くらいから飲んでも大丈夫でしょうか?
- 17
アルコールをMNZと併用することにより,紅潮,動悸,頻脈,悪心,嘔吐等のジスルフィラム様反応が起こる可能性があることが知られています。これは、MNZが肝の代謝酵素を阻害し、アセトアルデヒドが蓄積するためですが、アセトアルデヒドには肝毒性、心毒性があり、不整脈の原因にもなり、アルコールとMNZの併用に関連した突然死の報告もあり1)注意が必要です。
MNZ内服終了後のアルコールの再開に関して検討した研究はみあたりませんが、MNZ 250 mg を12時間毎に反復内服後の血中動態のデータでは、血中濃度は2時間目に最高値20.2μg/mLを示し、投与12時間目において4.5μg/mLを示したとのことですので2)、半減期は5時間程度と考えられ、従って、2日間以上空ければ、血中濃度は100分の1以下に低下しますので、臨床的な影響は大分低くなると考えられます。
1) Cina SJ, Russell RA, Conradi SE. Sudden death due to metronidazole/ethanol interaction. Am J Forensic Med Pathol 1996;17:343-6.
2) ラベファインパック® インタビューフォーム 2016年4月改訂第7版 - Vonoprazanとプロトンポンプ阻害薬(PPI)の違いについて
- 18
Vonoprazanはカリウムイオン競合型アシッドブロッカーに分類されており、胃酸分泌機序の最終段階であるプロトンポンプのカリウムチャンネルに可逆的に結合してその機能を障害して胃酸分泌を抑制します。一方のPPIは、プロトンポンプのαサブユニットに不可逆的に結合してその機能を障害して胃酸分泌を抑制します。いずれも血中から壁細胞の分泌細管に分泌されて、分泌細管の膜表面に現れたプロトンポンプを阻害します。分泌細管中に分泌されたPPIは分泌細管内の酸に触れることで活性型になり、それがプロトンポンプと非可逆的に結合しますが、言い換えれば、酸がなければ活性化されないため、完全に胃酸を抑制して無酸状態を達成することは不可能です。また、活性型のPPIは不安定であり、分泌細管内にその形態で長くとどまることはできません。そのため、血中からの供給がなくなるとそれ以降はプロトンポンプを阻害することができません。従って、CYP2C19のextensive metabolizerでは血中からの供給が早く無くなり効果が不十分になりやすいこととなります。Vonoprazanは、酸による活性化は不要で未変化体のままでプロトンポンプのカリウムチャンネルを阻害します。酸に対して安定であり血中からの供給がなくなっても分泌細管中にとどまることができるため、血中から消失し供給が無くなった後もプロトンポンプを阻害することが可能です1)。
また、プロトンポンプに対する阻害活性もVonoprazanは、ランソプラゾールの400倍強いことが報告されています2)。 血中濃度は、Vonoprazanの方がPPIの20分の1程度と低いのですが3)、これは、分布容積がおおきいことによります。従って、血中半減期はPPIよりも長くなり、これもより強い胃酸分泌抑制効果につながっていると考えられます4,5)。
1) Inatomi N, Matsukawa J, Sakurai Y, Otake K. Potassium-competitive acid blockers: Advanced therapeutic option for acid-related diseases. Pharmacology & therapeutics 2016.
2) Hori Y, Imanishi A, Matsukawa J, et al. 1-[5-(2-Fluorophenyl)-1-(pyridin-3-ylsulfonyl)-1H-pyrrol-3-yl]-N-methylmethanamin e monofumarate (TAK-438), a novel and potent potassium-competitive acid blocker for the treatment of acid-related diseases. The Journal of pharmacology and experimental therapeutics 2010;335:231-8.
3) 武田薬品工業株式会社. タケキャブ錠インタビューフォーム. 2015.
4) Dong SQ, Singh TP, Wei X, Yao H, Wang HL. A Japanese population-based meta-analysis of vonoprazan versus PPI for Helicobacter pylori eradication therapy: Is superiority an illusion? Helicobacter. 2017.
5) Jung YS, Kim EH, Park CH. Systematic review with meta-analysis: the efficacy of vonoprazan-based triple therapy on Helicobacter pylori eradication. Aliment Pharmacol Ther. 2017;46(2):106-14. - アモキシシリン(AMPC)はなぜ分2投与なのでしょうか?
- 19
AMPCは時間依存性の抗生物質であり、本来であれば3分割や4分割して投与されるべきです。そのためAMPCが分2投与となった経緯ははっきりしておりません。ただ、除菌レジメンの開発の時期の経過をみると、イタリアンレジメンであるPPI/CAM/MNZ療法が1日2回投与で高い除菌率を達成できたことから1)、三剤の1日2回投与がコンプライアンスの点からも標準的な投与方法となりました。その後、PPI/CAM/AMPCも1日2回投与で90%以上の除菌率を達成できたため2)、AMPCも1日2回投与が行われるようになりました。当時は、CAMの耐性率も低かったため、AMPCの短い半減期をCAMがカバーしてきたと考えられます。日本での治験が始まる際に、アモキシリリンの投与方法についても議論がなされたようですが、当時のCAM耐性率の低い状況では、複数の除菌療法に関する論文において、AMPCの2分割と3分割で差は認めなかったため、本邦でも2分割を採用することとなった経緯があります。
しかし、その後の研究で、AMPCの2分割と3分割では差があるとする報告もあり3)、除菌療法も耐性菌の状況に応じて内服方法も含めて再構築する必要があると考えられます。
1) Bazzoli F, Zagari M, Pozzato P, et al. Evaluation of short-term low-dose triple therapy for the eradication of Helicobacter pylori by factorial design in a randomized, double-blind, controlled study. Aliment Pharmacol Ther 1998;12:439-45.
2) Lind T, Veldhuyzen van Zanten S, Unge P, et al. Eradication of Helicobacter pylori using one-week triple therapies combining omeprazole with two antimicrobials: the MACH I Study. Helicobacter 1996;1:138-44.
3) Furuta T, Sugimoto M, Yamade M, et al. Effect of dosing schemes of amoxicillin on eradication rates of Helicobacter pylori with amoxicillin-based triple therapy. Journal of clinical pharmacology 2014;54:258-66. - 除菌治療の副作用にクロストリジウム・ディフィシル腸炎や急性出血性大腸炎は含まれますか?
- 20
含まれます。除菌後にクロストリジウム・ディフィシル腸炎(CDAD)を発症した例が報告されています1-3)。除菌治療中のみならず、除菌後1カ月程度は、抗菌薬ならびに胃酸分泌抑制剤の効果が残ると考えられており、腸内細菌叢の撹乱(ディスバイオ―シス)状態が考えられます。クロストリジウム・ディフィシル腸炎の検査は採便によって、毒素の検出や細菌培養を行ことで容易に検査できます。除菌治療後に下痢症状が持続する場合にはCDADを考慮にいれた検査を行い、陽性の場合には速やかにバンコマイシン、メトロニダゾールなどの適切な抗菌薬で治療する必要があります。
また、除菌療法後に急性出血性大腸炎を発症した例も報告されています4)。これ対してプロバイオティクスには抗菌薬による副作用防止効果が示されており、H. pylori感染症の除菌治療の際に使用していくことが有用であるとされています5)。
参考文献:
1) 久保 徳彦, 河内 修司, 有山 巌, 村田 昌之, 古庄 憲浩, 林 純: Helicobacter pylori除菌治療後に偽膜性腸炎を発症した1例 感染症学雑誌80(1):51-55, 2006
2) 浦吉俊輔、松本、宮谷博幸、吉田行雄:H. pylor2次除菌治療後にC. difficile腸炎を発症した1例 Progress of Digestive Endoscopy 86(1):178-179,2015
3) 中村真寿美、萩原 純、瀧口 徹、山口昌紘、桑原浩輔他:ピロリ菌3次除菌を契機に劇症型クロストリジウム・ディフィシル感染症を発症した1例 日本医科大学会誌:、12(4):166, 2016
4) 池上 玲一 神谷 和則 岩重 弘文: Helicobacter pylori感染症の2次除菌治療後に出血性大腸炎を発症した3例. 二本大腸肛門学会誌 68(6):419-424, 2015.
5) 神谷 茂:Helicobacter pylori感染症に対するプロバイオティクスの効果.腸内細菌学会誌 24 (1): 1 -12,2010
4.その他
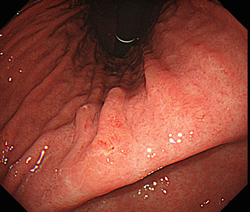
- ヒトの胃に感染する菌はH. pyloriだけですか?
- 1
ヒトの胃に感染する主な菌はH. pylori ですが、人獣共通感染症として胃NHPH(non-Helicobacter pylori Helicobacter)の感染も見られます1)。Helicobacter属は胃に感染するgastric NHPHとnon-gastric NHPHに大別できますが、gastric NHPHの中のH. heilmanniiやH. suisのヒトへの感染が報告されています。H. pylori未感染者が増加する中で、ヒトでの胃NHPH感染者が増えてきている印象があります。これまでの報告から、先進国では0.5%以下、東ヨーロッパとアジアでは1.2~6.2%であり、胃MALTリンパ腫との関連性が推測され2)3)、わが国の検討では0.4~0.6%、胃MALリンパ腫では20%との報告もあります1)4)。診断は鏡検で、H. pyloriより大型で螺旋が強い形態を呈するので、経験のある病理医であればそれほど難しくありません。ウレアーゼ活性は陰性か弱陽性であり、ウレアーゼ活性を用いた診断法では確診できません。PCR法を用いた診断でも精度に関しては十分とはいえません。胃NHPH感染の内視鏡像は、H. pylori の前庭部優位胃炎に近く、体部粘膜には軽度の浮腫のみでRACは観察されます。しかし、胃角部や前庭部に霜降り様に見える部分的な萎縮所見が特徴的とされています5)。H. pylori診断が陰性で、このような所見を認めた場合には、胃NHPHを疑い生検をすることをお勧めします。
文献
1) 中村正彦, Anders Overby, 児玉洋介ほか. Helicobacter heilmanniiおよびHelicobacter sruisと胃・十二指腸疾患. Helicobacter Research 20:225-231,2016
2) O’Rourke JL, Lee A, Kellow JE et al. Helicobacter Hailmannii and other gastric infections in humans. In: Infection of the Gastrointestinal Tract. 2nd ed. Ed by Blaser MJ, Smith PD, Ravdin JL et al. Raven Press, New York, 2001
3) Stolte M, Kroher G, Meining A, et al. A comparison of Helicobacter pylori and H. heilmannii gastritis. A Matched control study involving 404 patients. Scand J Gastroenterol 32:28-33,1997
4) Okiyama Y, Matsuzawa K, Hidaka E, et al. Helicobacter hailmannii infection: clinical, endoscopic and histopathological features in Japanese patients. Pathol Int 55:398-404, 2005
5) Shiratori S, Mabe K, Yoshii S, et al. Two Cases of Chronic Gastritis with non-Helicobacter pylori Helicobacter Infection. Intern Med. 2016;55:1865-9.図 胃NHPH感染の内視鏡像
- 自費診療とはどういうことですか?
- 2
2013年からすべてのH. pylori陽性者の除菌治療は保険診療の対象となっていますが、保険適用上の注意点と異なる診療を行う場合には、保険外診療(自由診療)の対象となり、費用は自己負担となります。
保険診療上は、①内視鏡検査によりH. pylori感染胃炎を疑う、②H. pyloriの感染診断を施行、③H. pylori陽性であれば除菌治療の順で行うことに決められています。内視鏡検査がされていない患者にH. pylori感染診断や除菌治療を行うこと、CAM耐性のチェックなしで初回除菌から二次除菌レジメから行う場合は自費診療の対象となります。また、三次除菌や薬物アレルギーなどで、保険で認められたAMPC、CAM、MNZの3剤以外の薬剤を用いて除菌治療を行う場合は自費診療です。
ピロリ専門外来として、自費診療で対応する外来を設置して対応している施設もあります1)。保険診療と自費診療を併用する「混合診療」を実施すると、本来は健康保険が適用される診療も含めて治療費全額が自己負担となるので注意が必要です。当院を含め多くのピロリ専門外来では、①1回目と2回目の除菌治療に失敗された方、②ペニシリンアレルギーなどで通常の除菌治療が受けることができない方、③中高校生で内視鏡を受けないで除菌を希望する方を対象としております2)。
文献
1)加藤元嗣、小野尚子、間部克裕ほか.ピロリ菌専門外来について.日本ヘリコバクター学会誌 11(2):70-73,2010
2)加藤元嗣、自費診療の基本と注意点.ピロリ除菌治療パーフェクトガイド第2版. P190-193榊 信廣編集.日本医事新報社,東京, 2017 - 成人になって感染することはありますか?それはどの位の頻度ですか?
- 3
H. pyloriは、乳幼児期に感染し持続感染することが知られております。成人になってから感染することも稀ながら報告されております。まず、成人においては経口感染しAGMLを発症する急性感染症の報告1)です。しかし、急性感染が起きた後、除菌治療を行わなくとも菌が排除される一過性感染に終わるという報告がみられます2)-4)。一方、H. pyloriによるAGML等がおきた際には、内視鏡を介する感染以外では初感染の証明がほぼ困難である5)ことから、自然排菌の可能性があっても除菌療法を行うべきとの報告もあります6)。
我々は、検診にて2008~2014年に2回以上HP抗体を自動的に測定している3693人の中で、抗HP抗体が陽転化しX線画像上も新規に感染が成立したと考えられる症例は4例(0.1%)と報告しました7)。Weckらにより 2011年に行われたメタ解析では、成人における新規感染の年間発生率は1.0%以下とされ、西洋諸国の成人では特に少ないと結論しています8)。また、Takeらは日本人において、除菌後の再燃を除いた再感染率についても0.2%と報告しています9)。
現代の日本の衛生環境では成人における新規感染が成立する可能性はあるが、極めて少ないと言えます。
文献
1)Sugiyama T、Naka H、Yabana T、et al. . Is Helicobacter pylori infection responsible for postendoscopic acute gastric mucosal lesions? Eur J Gastroenterol Hepatol 1992,4:S93-96.
2)大原 秀一, 関根 仁, 飯島 克則, 他.長期経過観察をしえたHelicobacter pylori感染による急性胃粘膜病変(AGML)の1例Helicobacter Research 2000;4: 87-91
3)八木 一芳, 中村 厚夫, 関根 厚雄.Regular arrangement of collecting venules(RAC)像より内視鏡施行時H. pylori初感染と診断されたAGMLの2例.Gastroenterological Endoscopy 2002; 44:656-660
4)茶谷 成, 矢田 智之, 大久保 恒希, 他.H. pylori感染を契機に急性胃粘膜病変を発症した1例.Progress of Digestive Endoscopy 2012;81:84-85
5)Sugiyama T、Naka H、Yachi A、et al. Direct evidence by DNA fingerprinting that endoscopic cross-infection of H. pylori is a cause of postendoscopic acute gastritis.
J Clin Micribiol 2000,38:2381-2382
6)福田 容久, 篠崎 香苗, 佐々木 貴英, 他.Helicobacter pyloriの急性感染が疑われた急性胃粘膜病変 6例の臨床経過とH. pylori感染診断の問題点について.日本消化器病学会雑誌2014;111:899-908
7)青木利佳. 検診施設における血清Helicobacter pylori抗体価の経時変化.日本ヘリコバクター学会学術集会プログラム・抄録集23回 2017:189
8)Weck MN, Brenner H. Apparent incidence of Helicobacter pylori in adulthood: to what extent do new infections reflect misclassification? Helicobacter. 2011;16:266-75.
9)Take S, Mizuno M, Ishiki K,et al. Reinfection rate of Helicobacter pylori after eradication treatment: a long-term prospective study in Japan, Journal of Gastroenterology 2012;47:641-646
